01-Ufsm PEIES – Uma importante cidade do Brasil é responsável pela emissão, a cada segundo, de 9,2 kg de NO2 (g) para a atmosfera, proveniente de veículos automotores. O número de moléculas de NO2(g) liberadas para a atmosfera, por segundo, é aproximadamente
a) 0,03 x 1023 b) 6,02 x 1023 c) 0,03 x 1026 d) 6,02 x 1025 e) 1,20 x 1026
2- UFSM PEIES – O ácido carbônico é um ácido fraco e instável, que sofre decomposição em gás carbônico e água da seguinte maneira:
H2CO3(aq)èCO2(g)+H2O(l)
Considerando essa informação e a reação da questão anterior, pode-se afirmar que a massa, em gramas, de Na2CO3(s), que originará 2,24L de CO2(g), nas CNTP é, aproximadamente,
a) 0,16 b) 0,56 c) 5,6 d) 10,6 e) 20,6
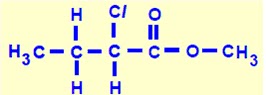
3 - PUC Nas últimas décadas, o consumo de margarina vem se elevando no Brasil, através da substituição da manteiga e do crescente aumento na manufatura e na ingestão de produtos alimentícios industrializados contendo gordura hidrogenada. Na obtenção de margarinas a partir da hidrogenação catalítica de óleos vegetais, uma reação das que ocorrem pode ser representada por:
C17H31COOH + 2H2 è CH3 – (CH2)16 – COOH
ácido linoléico ácido esteárico
Com base na equação apresentada acima, o volume de gás hidrogênio, em litros, que deve ser usado para a conversão total de 28,0 g de ácido linoléico em ácido esteárico, sendo o volume molar de 9,08 L quando a temperatura é de 170 oC e pressão de 4 atm, é de, aproximadamente,
A) 1,81 B) 2,24 C) 3,62 D) 4,48 E) 6,89
4 - PUC Em 2,8kg de óxido de cálcio, também conhecido como “cal virgem”, foi adicionada água, formando hidróxido de cálcio, usado para pintar uma parede.
Após a sua aplicação, transformou-se numa camada dura, pela reação química com gás carbônico existente no ar, formando carbonato de cálcio. A massa de sal obtida é, aproximadamente, igual a
A) 5,0Kg B) 2,8Kg C) 1,6Kg D) 1,0Kg E) 0,6Kg
5 - PUC Uma droga psicoativa vendida como estimulante, C10H15N, sofre uma série de reações após ser ingerida. O resultado dessas reações é a oxidação da droga pelo oxigênio para produzir CO2, H2O e N2.
A ingestão de 0,298g dessa droga deve, teoricamente, produzir
A) 0,02 mols de dióxido de carbono.
B) 0,1 mol de nitrogênio.
C) 0,14g de água.
D) 0,44g de dióxido de carbono.
E) 0,28g de nitrogênio.
6 - PUC O carbeto de silício (SiC) possui uma estrutura idêntica à do diamante e, por isso, apresenta elevada dureza, sendo utilizado, por exemplo, na confecção de esmeril para afiar facas e no corte de vidros. Uma forma de obtenção do carbeto de silício dá-se por meio da reação de aquecimento de coque com areia, conforme expressa a equação a seguir:
A massa de carbeto de silício, em kg, que se forma a partir da utilização de 1kg de carbono presente no coque é, aproximadamente,
A) 0,33 B) 0,78 C) 1,11 D) 1,44 E) 3,33
7 - PUC Da hidrólise do carbureto de cálcio, de fórmula CaC2, obtêm-se o etino e o hidróxido de cálcio. O número de mols de água necessários para consumir, totalmente, 2 mols de carbureto é
A) 0,5 B) 2 C) 4 D) 6 E) 8
8 - UFRGS Pelas convenções atuais, um mol de qualquer substância é a quantidade de matéria que
a) corresponde a sua massa molecular.
b) corresponde a 6,02.1023 unidades de massa atômica da substância.
c) apresenta volume de 22,4 litros nas CNTP.
d) apresenta 6,02.1023 unidades estruturais dessa substância.
e) está contida em 6,02.1023 g dessa substância.
9 - PUC A ilustração
H2SO4(aq) + 2NaOH(aq) è Na2SO4(aq) + 2H2O(l),
A) representa uma reação de oxi-redução.
B) mostra que uma molécula de ácido sulfúrico reage com duas moléculas de hidróxido de sódio.
C) mostra que 1g de ácido sulfúrico em solução aquosa reage com 2g de hidróxido de sódio, também em solução aquosa.
D) permite concluir que, para formar 18g de água, são necessários 98g de ácido sulfúrico.
E) representa a formação de um mol de sulfato de sódio em solução e dois mols de água líquida a partir dos respectivos reagentes.
10 - UFRGS Abaixo são feitas três afirmações a respeito da combustão completa de 5,80 g de butano conforme a seguinte equação.
C4H10(g) + 13/2 O2(g) è 4 CO2(g) + 5 H2O(l)
I
|
-
|
Ocorre o consumo de 0,650 mol de oxigênio.
|
II
|
-
|
Ocorre a formação de
|
III
|
-
|
Ocorre a produção de
De gás carbônico nas CNTP.
|
Quais estão corretas?
a) Apenas I. b) Apenas II. c) Apenas III. d) Apenas I e III. e) I, II e III.
11 - UFRGS A combustão completa da glicose, C6H12O6, é responsável pelo fornecimento de energia ao organismo humano. Na combustão de 1,0 mol de glicose, o número de gramas de água formado é igual a
a) 6. b) 12. c)18. d) 108. e) 180.
12 - UFRGS O número de moléculas de oxigênio necessário para a combustão completa de uma molécula de heptano é igual a
a) 8. b) 11. c) 14. d) 15. e) 22.
Gabarito:
1-E 2-D 3-A 4-A 5-A 6-C 7-C 8-D 9-E 10-D
11-D 12-B